Een genlocus op chromosoom 13 en hoe men ertoe kwam
Inleiding
Hoewel autosomaal dominante overerving beschreven is van mitralisklepprolaps en
mitralisklepprolaps optreedt bij bindweefselstoornissen zoals de ziekte van
Marfan, hebben voorgaande studies gefaald in het vinden van linkage van
familiale mitralisklepprolaps met fibrillaire collageengenen. Deze negatieve
linkage resultaten kunnen te wijten zijn aan gebrek aan systematisch onderzoek
van het gehele genoom en de onzekerheid van de fenotypische diagnose.
Recentelijk is er, naast de vanzelfsprekende verbetering in
laboratoriumtechnieken, een sterke verbetering geweest van het inzicht in de
vorm van de mitralisklep, de specificiteit van de echocardiografische
diagnostiek, waardoor een kwalitatief beter vertrekpunt ontstond voor genetische
studies.
De studies naar genloci op chromosomen 11, 16 en geslachtschromosoom X lieten reeds de kracht van de fenotypering zien en bevestigen de genetische heterogeniciteit van deze veelvoorkomende aandoening.De bevindingen uit deze studies suggereren de hypothese dat mitralisklepprolaps een gezamenlijke uitkomst kan zijn van een of meerdere genetische defecten vergelijkbaar met familiale hypertrofische cardiomyopathie. Het vinden van extra loci die verschillende maar wel functioneel gerelateerde genen bevatten kan behulpzame aanwijzingen geven voor de genidentificatie en verbetering van het inzicht in de pathogenese, met als uiteindelijk doel de ontwikkeling van doelgerichte therapieŽn. Het bestuderen van familiale mitralisklepprolaps kan tevens meer inzicht geven in de klinische bevindingen van momenteel onbekende significantie door te gaan testen op linkage bij individuen met variaties in mitralisklepmorfologie die niet voldoen aan de standaardcriteria. In het nu volgende stuk wordt beschreven hoe men tot de vondst van een locus op chromosoom 13 is gekomen.
Methodiek
Stamboomcollectie
Deze studie werd gedaan op een stamboom met 46 individuen verdeeld over drie generaties. Echocardiografie en bloedstalen werden verkregen van 43 leden. De familie werd geselecteerd vanwege zijn grootte, het aantal leden met volledig gediagnosticeerde mitralisklepprolaps en de afwezigheid van de tekenen van Marfan.
Klinische evaluatie
Er werd een
gedetailleerde anamnese gedaan bij elk familielid met speciale aandacht voor de
volgende zaken:
(1) een bewijs voor de syndroom van Marfan of andere bindweefselstoornissen;
(2) een geschiedenis van paniek aanvallen met anticipatieangst of een
soortgelijke;
(3) thoraxdeformaties;
(4) symptomen van pijn op de borst, kortademigheid en palpitaties;
(5) progressie van mitralisklepregurgitatie, chordale ruptuur en chirurgische
klepreparatie; (6) geschiedenis van plotse dood met of zonder reanimatie;
(7) geschiedenis van congenitale hartziekte, cardiomyopathie of coronair lijden.
Meer specifiek werd het syndroom van Marfan bevraagd met behulp van items als de
aanwezigheid van gewrichtlaxiteit, een grote lichaamslengte met relatief lange
ledematen, aortadissectie en aneurysmata, scoliose en oculaire afwijkingen. Deze
aandoening werden tevens uitgesloten met behulp van oppuntstelling van
lichamelijke kenmerken en echocardiografische evaluatie van de aorta.
Verzameling van gegevens
Bloedstalen werden verzameld van 43 van de 46 familieleden op het moment van echocardiografie. Getransformeerde lymfoblastcellijnen werden verkregen bij hen met bevestigde mitralisklepprolaps. Er werden complete driedimensionale en Doppler-echocardiogrammen gemaakt met een 2,5 tot 5,0 MHz transducer voor optimale resolutie. Mitralisklepprolaps werd gediagnosticeerd in de lange as aanzichten die de hoogste annulaire punten bevatten. De mediale, centrale en laterale schelpen werden systematisch gescand om de maximale systolische klepbladverplaatsing ten opzichte van de annulus te meten. Personen met zowel verdikte (groter dan 5 mm) als relatief dunne klepbladen werden geacht volledig diagnostische mitralisklepprolaps te hebben, omdat beide optraden binnen dezelfde stamboom. Omdat het laterale klepblad moeilijk te evalueren is op het lange as aanzicht, werd verplaatsing hiervan gemeten in het apicale vierkameraanzicht, maar altijd bevestigd in de lange as scans. De dikte van het middendeel van het klepblad werd onderzocht tijdens diastase van de klepbladen om focale verdikking uit te sluiten.
Echocardiografische classificatie
Echocardiografische classificatie werd gedaan voor de genetische analyse. Op basis van eerdere klinische en prognostische studies wordt klassieke mitralisklepprolaps gediagnosticeerd wanneer de klepbladverplaatsing de 2 mm overschrijdt en de maximale dikte groter is dan 5 mm. Mitralisklepprolaps wordt beschouwd als niet-klassiek wanneer de klepbladverplaatsing de 2 mm overschrijdt maar de maximale dikte kleiner is dan 5 mm. Tijdens de genetische studie werd gekeken naar zowel de klassieke als de niet-klassieke vorm. De varianten met een onzekere klinische significantie werden beschreven aan de hand van het veelvoorkomende kenmerk van posterieure klepbladasymmetrie, hetgeen frequent voorkomt bij hen met een duidelijke diagnose.
Zes individuen met borderline gradaties van verplaatsing (minder dan 2 mm verplaatsing van het posterieure klepblad en niet geassocieerd met toegenomen klepbladverdikking, mitralisklepregurgitatie, vergroting van het linker atrium of klepgerelateerde complicaties) werden geclassificeerd in de groep "minimale systolische verplaatsing" en deze zes individuen werden beschouwd als "diagnostisch onduidelijk" in plaats van als "niet aangedaan" bij de genetische analyse. Deze methode liet toe dat in sommige gevallen een minimale verplaatsing kon worden gezien als een vorm van milde expressie en niet een fysiologische variant van de klepbladpositie.
Ook werd een interessante prodromale morfologie herkend. Bij deze personen is er conform de criteria geen duidelijke klepbladverplaatsing ten opzichte van de annulus, maar een patroon van klepbladsluiting of coaptatie overeenkomstig met dat van hen die wel aan de criteria voldoen. Normaal gesproken treffen de klepbladen elkaar posterieur binnen de linker ventriculaire caviteit omdat het posterieure klepblad korter is dan het anterieure. Bij patiŽnten met mitralisklepprolaps is de coaptatie typisch naar anterieur verplaatst, hetgeen consistent is met de elongatie van het posterieure klepblad en wat een excessieve klepbladbeweging kan veroorzaken, niet alleen binnen het linker atrium maar ook richting de aorta. Deze verplaatsing blijkt kwantitatief gecorreleerd te zijn met de posterieure klepbladlengte. Daardoor wordt de suggestie gewekt dat het hierbij gaat om een prodromale manifestatie van familiale mitralisklepprolaps, zonder de diagnostische klepbladverplaatsingscriteria, maar wel met twee andere kenmerken: anterieure verplaatsing van het coaptatiepunt meer dan 40% langs de annulus en een klepblad coaptatiepatroon gelijkaardig aan dat gezien bij familieleden met volledige expressie. Dit patroon van relatief uitpuilen van het posterieure klepblad naar anterieur, dat gezien wordt bij alle patiŽnten met posterieure klepbladprolaps en bij velen met een prolaps van de twee klepbladen, werd gezien bij twee leden van deze stamboom. Vanwege de gelijkaardigheid met volledig gediagnostiseerde mitralisklepprolaps, werden deze personen gecodeerd als ďaangedaanĒ binnen de studie.
Genoomscan en linkage analyse
Voor het
starten met het scannen van het hele genoom, de genoomscan, werd met het SLINK
programma geverifieerd dat de stamboom geschikt was voor de detectie van linkage.
Om te bepalen in hoeverre de familie iets te maken had met de reeds bekende
MMVP1 en MMVP2 loci, werd een subset van de familie gegenotypeerd voor de
volgende markers:
MMVP1,
D16S404-D16S3103-D16S420-D16S3133-D16S3068-D16S3080-D16S515;
en
MMVP2,
D11S4046-D11S4124-D11S2349-D11S1338-D11S1331-D11S932-D11S4465-D11S1349-D11S902-D11S1359-D11S904-D11S914-D11S935-D11S905.
Omdat geen bewijs voor linkage werd gevonden, werd de genoomscan uitgevoerd op
14 familieleden, waarbij een panel van 382 genetische markers werd gebruikt, die
het volledige humane genoom dekken tot op 10cM intervallen nauwkeurig. Het
betreft hier het MGH Genomics Core Facility linkage panel, waarvan het grootste
deel afkomstig is van de ABI Prism Linkage Mapping Set versie 2.5. De gemiddelde
heterozygositeit van deze markers is 0,79. Specifieke allelfrequenties zijn
beschikbaar op www.appliedbiosystems.com. Wanneer een betere mapresolutie nodig
was, werden markers toegevoegd uit de Cooperative Human Linkage Center Weber
Human Screening Set versie 8. Indien beschikbaar werden de markerafstanden
verkregen uit de Marshfield sekse gemiddelde genetische kaart (http://research.marshfieldclinic.org).
De fysieke locatie werd gebruikt om korte genetische afstanden te bepalen,
indien in de beschikbare linkage map geen markers beschikbaar waren. Behalve bij
de X-gebonden vorm, bleek familiale mitralisklepprolaps in de meeste gevallen te
segregeren als een autosomaal dominante aandoening met verminderde penetrantie.
Omdat het ware genetische model van mitralisklepprolaps onbekend was ten tijde
van de studie werd initieel een niet parametrische linkage (NPL) analyse gedaan
met behulp van het GENEHUNTER programma. Dit type van analyse onderzoekt allelen
die aangedane individuen gemeenschappelijk hebben en behoeft geen specificatie
van het genetisch model. Daarom kan deze NPL analyse fenotype-allel associaties
tonen, die gemist kunnen worden bij een parametrische analyse van een incorrect
model. Het GENEHUNTER programma beperkt de stamboom met een specifieke formule,
namelijk 2n - f ≤ 20 (met n is 'nonfounders' en f is 'founders'). GENEHUNTER
kapt stambomen die deze afmeting overschrijden af. Na analyse van de
genoomscandata werden alle individuen gegenotypeerd voor markers op chromosoom
13. Om de genetische analyse op de gehele familie uit te voeren werden tevens
tweepunts LOD-scores berekend tussen de ziekte en de individuele markers,
waarbij gebruik werd gemaakt van het MLINK programma van FASTLINK 3.0. Daarbij
werden multipunts LOD-scores voor de hele familie berekend met LINKMAP. Omdat
mitralisklepprolaps geassocieerd is met zowel geslachtafhankelijke als
leeftijdsafhankelijke penetrantie werd de analyse uitgevoerd op basis van het
eerder beschreven model. Het betreft hier een autosomaal dominante overerving
met onvolledige penetrantie en een ziektegenfrequentie van 0,005, met een
fenokopieratio van 1% als bijdrage voor de hoge incidentie van sporadische
mitralisklepprolaps. Penetrantie voor een leeftijd boven de 15 jaar zat op de
95% voor de vrouwen en 63% voor de mannen. Voor een leeftijd onder de 15 jaar
was dit respectievelijk 32% en 21%. Om te bewijzen dat de linkage bevindingen
"waterdicht" waren voor het aangenomen genetische model, werd ook een strenger
model gebruikt waarin alle niet aangedane personen jonger dan 40 jaar
uitgesloten werden en een complete penetrantie van de ziekte zonder fenokopieŽn
werd aangenomen. Om de beperkingen van GENEHUNTER met betrekking tot
familiegrootte te overkomen en bij het beperkte aantal markers gebruikt in
LINKMAP, werd een SIMWALK analyse uitgevoerd, die evaluatie van de gehele
stamboom met gebruik van alle 31 markers op chromosoom 13 toeliet. Haplotypes in
de gelinkte regio werden manueel geconstrueerd en bevestigd met zowel GENEHUNTER
als SIMWALK.
Fysieke en transcriptie kaarten
Op basis van data van de UCSC Human Genome Browser in mei 2004 werden een fysieke kaart en een transcriptie kaart voor de MMVP3 locus geconstrueerd.
Resultaten

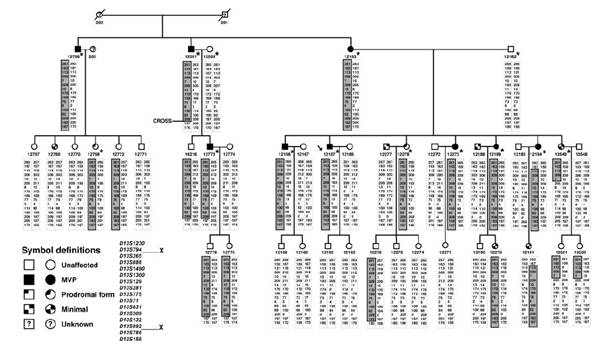
Figuur 1. De stamboom die werd gebruikt door de onderzoeksgroep van Nesta
In de afbeelding is de complete stamboom te zien. De beide stamoudsten zijn van West- Europese afkomst. Bloed en echocardiografie werden verkregen van 43 van de 46 personen (19 mannelijke en 24 vrouwelijke personen in de leeftijd tussen 7 en 75 jaar). De twee stamoudsten werden geŽlimineerd en persoon 203 deed niet mee. De echocardiografische karakteristieken van de negen patiŽnten die volledig aan de klinisch diagnostische criteria voor mitralisklepprolaps voldoen worden in de tabel vermeld.
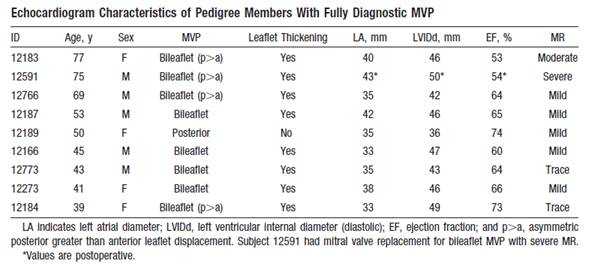
Figuur 2. De echocardiografische karakteristieken van de patiŽnten die aan de diagnostische criteria voldoen. Uit het artikel van Nesta.
Twee van deze negen personen hadden gemiddelde tot ernstige mitralisklepregurgitatie, een had geruptureerde chordae tendineae die chirurgische interventie behoefte. Geen van de onderzochte personen had endocarditis of plotse dood in de voorgeschiedenis. In de hele stamboom waren geen extracardiale manifestaties van bindweefselabnormaliteiten of ziekte van Marfan aanwezig. Vier personen, twee met mitralisklepprolaps en twee zonder, hadden paniekaanvallen in hun voorgeschiedenis. Drie leden met mitralisklepprolaps volgens de diagnostische criteria hadden een combinatie van pijn op de borst, kortademigheid en palpitaties. Van hen had slechts ťťn voorkamerfibrillatie op elektrocardiogram. Geen van de individuen had thoracale deformaties. Een van de niet aangedane individuen had een bicuspide aortaklep en geen van de familieleden was bekend met cardiomyopathie of coronair lijden.
Morfologische heterogeniteit
Het bekijken en vergelijken van echobeelden van verschillende familieleden leverde een scala aan fenotypische morfologieŽn op. Van de 43 individuen uit de stamboom hadden er volgens de criteria negen mitralisklepprolaps met een variŽrende betrokkenheid van het klepblad, waarvan vijf van de negen een asymmetrische prolaps van het posterieure klepblad. Dit is een veelvoorkomend patroon voor mitralisklepprolaps. Klepbladverdikking en graad van mitralisklepregurgitatie varieerden. Zes gerelateerde individuen hadden vormen die niet voldeden aan de huidige diagnostische criteria: twee met de prodromale morfologie en vier met minimale verplaatsing. Daar komt bij dat de twee broers/zussen in de tweede generatie ook een minimale verplaatsing hadden. Al deze individuen hadden een asymmetrische coaptatie gemeen, evenals de meesten die voldeden aan de volledige diagnostische criteria. Deze asymmetrie werd dikwijls opgemerkt door een excentrische naar anterieur gerichte regurgitatiestroom. Bij de prodromalen was de coaptatie naar anterieur verplaatst naar een punt 50% boven de annulaire diameter (normaal 25%).
Genoomscan en linkage analyse
SLINK
analyse voorspelde dat de stamboom een Ďsterkteí van ongeveer 50% had voor de
detectie van een LOD-score van 2,0, hetgeen bewijs zou suggereren van linkage.
De maximale voorspelde LOD-score verkregen uit een sample van 500 replicanten
was 4,62 en de gemiddelde LOD-score was 2,09. Daarom werd een genoomscan
uitgevoerd voor 14 individuen, inclusief 9 individuen met volledige
diagnostische mitralisklepprolaps, de 2 prodromalen, 1 individu met minimale
systolische verplaatsing en 2 niet aangedane individuen (de ouders van generatie
3). De GENEHUNTER resultaten van de initiŽle genoomscan toonden vier regio's met
NPL scores boven de 2,0 en P<0,05 op chromosomen 4, 11 (58 cM van MMVP2
gelegen), 13 en 18. De hoogste scores werden verkregen voor chromosoom 13 met
D13S170 (NPL= 3,04; P<0,01) en D13S265 (NPL=6,62; P<0,004). Ervan uitgaande dat
het beste bewijs voor linkage op chromosoom 13 te vinden was,
werden de genetische
marker maps doorzocht en de gehele familie gegenotypeerd met de markers die
D13S265 omgeven. GENEHUNTER analyse van familielid 14 gaf een piek NPL-score van
18,41 rond een 5,0 cM gebied tussen D13S886 en D13S309 met een overeenkomstige
parametrische LOD-score van 2,44. De maximale tweepunts parametrische LOD-score
verkregen met FASTLINK over de gehele familie was 2,81 met de marker D13S1490 en
de parametrische multipunts LOD-score van 3,71 over de gehele familie was
verkregen met LINKMAP met de markers D13S886, D13S129 en D13S132. Om ten volste
gebruik te kunnen maken van alle familie- en markerinformatie werd een SIMWALK
analyse gedaan voor alle 31 markers op chromosoom 13. Deze analyse bevestigde
significantie van de GENEHUNTER en FASTLINK resultaten. De NPL piekt op dezelfde
locatie als GENEHUNTER met bijna identieke probabiliteitwaarden (P=0,0006 resp.
0,0007). Ook was een goede overeenkomst verkregen uit de parametrische analyse
met een FASTLINK-score van 3,17 en een SIMWALK-score van 2,996. Om te bevestigen
dat de bevindingen voor linkage geschikt waren voor een model werden een
parametrische en niet parametrische analyse uitgevoerd. De maximale tweepunts
parametrische LOD-score verkregen met FASTLINK was 2,22 voor marker D13S132.
GENEHUNTER analyse van de stamboom gaf een identieke NPL-score van 18,41 (P<
0,0007).
Deze resultaten gecombineerd met haplotype analyse binnen de familie bevestigen
linkage van MMVP3 aan 18,61 cM regio op de lange arm van chromosoom 13. Iedereen
met een volledig diagnostische mitralisklepprolaps en prodromale familieleden
delen een haplotype met een 12-allelenkern voor de markers D13S265 tot en met
D13S892. Vijf niet aangedane individuen (12772, 14216, 12776, 12775 en 12276)
bleken niet-expressieve dragers van het haplotype, waarvan er drie jonger zijn
dan 15 jaar en de andere twee 30 en 36 jaar. Dit is consistent met een model van
leeftijdsafhankelijke penetrantie zoals geobserveerd in eerdere familiestudies.
Van de vier gerelateerde individuen met een minimale systolische stoornis hadden
er twee het complete haplotype (12270 en 12191) en een (13549) droeg het ziekte
haplotype voor de proximale drie markers.
Een recombinatie bij individu 12184 tussen markers D13S794 en D13S265 definieert
de proximale grens van de gelinkte regio, terwijl een recombinatie in individu
12591 tussen markers D13S892 en D13S786 de distale grens vastlegt.
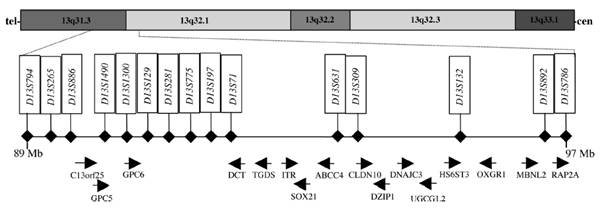
Figuur 3. De situering van de genlocus op chromosom 13.
Het complete ziekte haplotype en de locaties van de proximale en distale crosses die het 8,2 Mb kandidaat interval definiŽren, wordt getoond in de afbeelding. De resultaten bevestigen dat een derde MVP locus, MMVP3, ligt tussen D13S794 en D13S786 op chromosoom 13q31,3-q32,1. De huidige transcriptiekaart voor deze regio bevat 16 genen en toont gelijkaardigheid met het muizenchromosoom 14.
Discussie
Deze analyse toont aan dat er een locus voor autosomaal dominante
mitralisklepprolaps (MMVP3) gelegen is op de lange arm van chromosoom 13. Deze
bevinding bevestigt verder de genetische heterogeniteit van mitralisklepprolaps,
aangezien deze eerder al gelinkt werd aan chromosomen 11 en 16 en het
geslachtschromosoom X. In tegenstelling tot eerdere negatieve studies toont de
identificatie van loci op de chromosomen de kracht van de huidige aanpak
gecombineerd met de huidige diagnostische criteria met systematische
genoomscanning. Genetische heterogeniteit biedt mogelijkheden om de relaties
tussen genetische defecten en verschillen in expressie van ziekte en anamnese te
onderzoeken, evenals het bieden van aanwijzingen in de zoektocht naar genen. De
genetische analyse heeft belangrijke klinische inzichten opgeleverd en een
spectrum van expressies onthuld die vroeger als een normale variant werden
beschouwd,maar nu worden gezien als hebbende dezelfde genetische basis in de
familiale context. Hoewel dikke klepbladen en mitralisklepregurgitatie
geassocieerd zijn bij de individuele patiŽnt, treedt een spectrum van
klepabnormaliteiten op binnen een familie, die kunnen variŽren in de ziekte
expressie, het stadium van progressie en in modificerende factoren. Dit spectrum
omvat ook familieleden met minimale stoornissen die juist door studies als deze
gevonden kunnen worden. Het kan duiden op milde of vroege genexpressie die dus
opgevolgd dient te worden. Het herkennen van vormen is belangrijk omdat de
ziekte zich vaak klinisch manifesteert rond de 40 tot 60 jaar als ernstige
cardiale aandoening. Vroege interventie om klepblad spanning te verminderen bij
genetisch verdachte individuen, zoals bij een Marfan voor aortadilatatie, kan
potentieel preventief zijn voor progressie naar complicaties en hartfalen.
De herkende prodromale morfologie, die bij eerdere studies nog niet eerder werd
gemeld, werd ook verkregen in de familie gelinkt aan de MMVP2 locus op
chromosoom 11. Bij het bekijken van alle echocardiogrammen vond men in deze
studie vijf individuen met een prodromale morfologie, die dragers van het
haplotype bleken, evenals nog een ander individu met een minimale systolische
verplaatsing. In de familiale context had hierdoor de prodromale bevinding
diagnostische waarde en kracht. Dit is aannemelijk omdat deze morfologie, een
naar anterieur verschoven coaptatie, kan worden geassocieerd met een toegenomen
lengte van het posterieure klepblad. Deze associatie werd herkend bij
chirurgische reparatie van patiŽnten met lange posterieure klepbladen,die
voorbeschikt zijn tot anterieure coaptatie verschuiving en obstructie van de
linker ventriculaire outflow tractus. Kwantitatief werd gevonden dat de hoogte
van coaptatie in relatie tot de annulus of linker ventriculaire diameter
gecorreleerd is met de ratio van anterieure en posterieure klepbladlengte (r=
0,83 tot 0,85) in de chromosoom 11 familie. Door deze bevindingen kan een
minimale stoornis niet langer beschouwd worden als een normale variant in de
familiale context. Posterieure klepbladasymmetrie blijkt en belangrijke rol te
hebben in het mechanisme van mitralisklepregurgitatie en de definitie van
mitralisklepprolaps. Genetische studies zijn daarom belangrijk om inzicht te
geven in de beste klinische aanpak voor individuen met zulke eerder niet
gediagnosticeerde kenmerken. De associatie tussen vormen die niet aan de
diagnostische criteria voldoen en de MVP-loci kan niet geŽxtrapoleerd worden
vanuit de context van familiale mitralisklepprolaps. Zoals bij hypertrofische
cardiomyopathie waarbij het onderscheid tussen de normale variatie en
pathologische hypertrofie gemaakt moet worden bij genetische studies laat de
familiale context het gebruik toe van meer gevoelige criteria zonder opoffering
van de specificiteit. Follow-up studies zijn nodig om te bepalen in hoeverre
deze niet diagnostische vormen zich ontwikkelen en van welke factoren dit
afhangt.
De huidige transcriptiekaart voor de 8,2 Mb MMVP3 kandidaatregio op chromosoom
13q31,3-32,1 bevat 16 genen, die overeen blijken te komen met muizenchromosoom
14. Een intimadikte gerelateerde receptor (ITR) werd geÔsoleerd uit een hart
cDNA bibliotheek. Het bevat een N-terminale signaalsequentie, zeven
transmembranaire domeinen en een kentekenmotief gevonden in een lid van de
rhodopsineachtige G-proteÔne-gekoppelde receptor superfamilie. ITR-null muizen
suggereren dat dit gen belangrijk is in de regulatie van vasculaire remodeling.
Glypicaan 5 en 6 (GPC5 en 6) zijn leden van de familie van de celoppervlakte
heparansulfaat proteoglycanen die een belangrijke rol spelen in de celgroei,
controle en differentiatie. GPC6 is gevonden in de mesenchymale weefsels van
muizenembryo's. Het is geweten dat myxomateuze kleppen significant meer glycosaminoglycanen bevatten dan controle kleppen. Dit suggereert dat deze genen
een hoge prioriteit voor screening hebben.
Zoals eerder gemeld is men er nog niet achter om welk gen binnen deze locus het
gaat.